1。化学反应速率(v)
⑴定义:用来衡量化学反应的速度,单位时间内反应物或生成物的量的变化
⑵表达方式:浓度下降或单位时间内产物浓度上升来表达
⑶计算公式: V =δ c/δ t(υ:平均速率,δc:浓度变化,δt:时间)单位:
φ影响因素:
①决定因素(内因):反应物的性质(决定因素)
② 条件因素(外因):反应所处的条件
 ②条件因素(外部因素):反应条件
②条件因素(外部因素):反应条件
(1)参与反应的物质有固体和液体。因为压力的变化对浓度的影响很小,所以可以认为反应速率不变。※注意:
(2)惰性气体对速度的影响
①温度和体积不变:充入惰性气体→总压增加,但分压不变,各物质浓度不变→反应速率不变
②恒温定容:充入惰性气体→增加体积→降低各反应物浓度→减慢反应速率
化学平衡
1.定义:
化学平衡态:在一定条件下,当进行可逆反应,直到正负反应速率相等时,其他组分的浓度不再变化,就会达到一个表面静止的“平衡”,这是这个反应所能达到的极限,也就是化学平衡态。
2.化学平衡的特征
逆(研究前提是可逆反应)
等。(同一物质的正反向反应速率相等)
动态(动态平衡)
固定(每种物质的浓度和质量分数不变)
变化(条件变化,平衡变化)
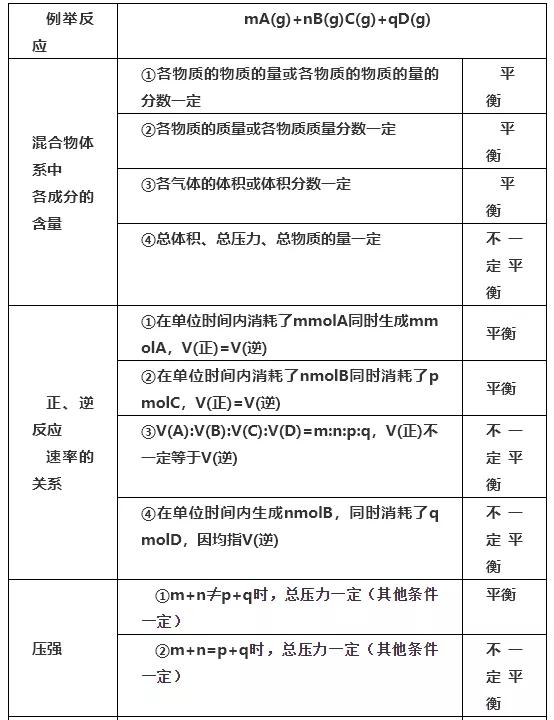
3.判断平衡的依据
判断可逆反应达到平衡的方法和依据


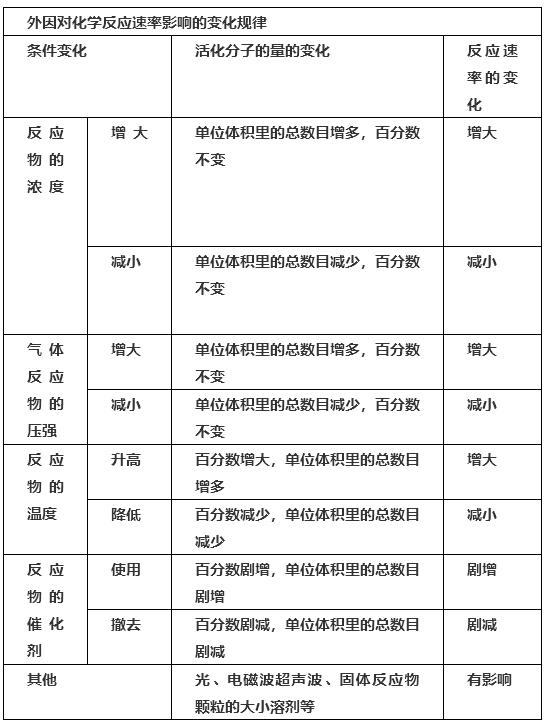
4-1。浓度对化学平衡移动的影响
(1)影响规律:在其他条件不变的情况下,提高反应物浓度或降低产物浓度,可使天平向正方向移动;增加产物的浓度或降低反应物的浓度会使平衡向相反的方向移动
(2)增加固体或纯液体的量,因为浓度不变,平衡不动
(3)如果溶液被稀释,反应物的浓度会降低,产物的浓度也会降低 V也降低,但降低的程度不同。总的结果是,化学平衡向反应方程式中化学计量数之和更大的方向移动。
4-2。温度对化学平衡移动的影响
影响规律:在其他条件不变的情况下,温度升高会使化学平衡向吸热反应移动,温度降低会使化学平衡向放热反应 [/] 移动
4-3。压力对化学平衡运动的影响
影响定律:在其他条件不变的情况下,增加压力会使天平向体积减小方向移动;当压力降低时,平衡会向体积增加的方向移动。
注:
(1)改变压强不能移动没有气态物质的化学平衡
(2)气体减压或加压的化学平衡移动规律类似于溶液稀释或浓缩的化学平衡移动规律
4-4,催化剂对化学平衡的影响:
因为催化剂对正反应速率和负反应速率的影响是相等的,平衡不动。然而,催化剂的使用会影响可逆反应达到平衡所需的时间。
4-5,勒查泰莱原则(平衡运动原则):
如果改变了其中一个条件(如温度、压力、浓度),天平就能减弱这种变化。
5,化学平衡常数
5-1,定义:
在一定温度下,当一个反应达到化学平衡时,产物浓度的幂的乘积与反应物浓度的幂的乘积之比是一个常数比。符号:K
5-2,使用化学平衡常数K时需要注意的问题:
1。表达式中每种物质的浓度是变化的浓度,而不是初始浓度或物质的量。
2。k仅与温度(T)有关,与反应物或生成物的浓度无关。
3。当反应物或产物中有固体或纯液体时,由于其浓度是固定的,可视为“1”,不代入公式。
4。对于稀溶液中的反应,如果有水,水的浓度就不用写在平衡关系中。
5-3,化学平衡常数K的应用:
1。化学平衡常数的值是可逆反应程度的标志。k值越大,平衡时产物的浓度越大,其正向反应的程度越大,即进行的反应越多。反之,则相反。
2。k值可以作为判断正在进行的可逆反应是否平衡,不平衡时以哪种方式建立平衡的标准。(Q:浓度积)Q<K:反应往前走;q=K:反应处于平衡状态;q>K:反方向反应
3。反应的热效应可以用K值来判断
如果温度升高,K值增大,那么正负应该是吸热反应 如果温度升高,K值减小,那么正负应该是。


1.反应熵变和反应方向:
(1)熵:物质的一种状态函数,用来描述系统的混沌程度,符号为s .单位:J.mol-1.k-1
(2)系统趋向于由有序变为无序,导致系统的熵增加。这叫熵增原理,也是判断反应方向的依据。。
(3)对于同一种物质,熵值在气态最大,液态次之,固态最小。那就是s(g)> s(l)> s(s)
2.反应方向的判断依据
在一定的温度和压力条件下,化学反应的解释依据是:
δh-δtδs < 0反应可以自发进行δh-δtδs = 0反应达到平衡δh-δtδs > 0反应不能自发进行
注:
(1)δH为负,δS为正,任何温度反应都可以自发进行
(2)当δ h为正,δ s为负时,任何温度反应都不可能自发进行[/s2/]