1、计算基础——化学方程式表达的意义
在方程式中,化学计量数之比等于粒子数之比,也等于物质的量之比,对于有气体参与的反应,也等于体积之比。
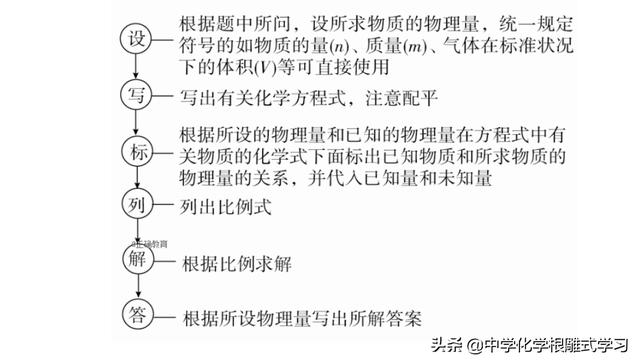
2、计算思路
3.典型例子
将2.3克钠放入97.8克水中,反应后,得到100毫升溶液。
(1)标准条件下产生的氢气体积是______________ _。
(2)得到的氢氧化钠溶液的溶质质量分数为_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _的质量分数
(3)所得到的氢氧化钠溶液的摩尔浓度为___________摩尔浓度为________摩尔浓度
(4)在K2Cr2O7+14HCl(浓)= = 2kcl+3cl2 ↑+7h2o+2ccrcl3的反应中,当转移0.3摩尔电子时,生成的cl2的体积为______________(标准状态),被氧化的HCl的量为_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _。



4.专心
(1)书写规范:各种符号的书写要规范,大写字母和小写字母的含义不同。比如“m”代表摩尔质量,“m”代表质量,“n”代表粒子数,“n”代表物质的量。
(2)符号规范:
(1)让未知数直接用各种物理量的符号表示,要注明物质(或粒子)的符号。设反应中HCl溶液的体积为V[HCl(aq)]。
②物理量和单位、物质的名称和分子式等。应该尽可能用符号来表示。如果已知NaOH溶液的体积和物质的浓度,则NaOH溶液的质量写成:m(NaOH)= c(NaOH)×v[NaOH(AQ)]×m(NaOH)。(3)单位说明:已知量代入计算公式时,应取单位,统一。
(4)建立的关系和数量既要遵循化学反应原理,又要符合实际意义。
(5)注意左右单位的对应,上下单位要一致。
(6)整个计算过程需要:结构完整,组织清晰,重点突出,书写规范,有化学意义。