溶液中溶质的质量分数的定义、求解方法、溶液稀释与增浓相关问题的求解方法是初中化学学习的重点内容。
1、溶液中溶质的质量分数的定义与意义
1.1、溶液中溶质的质量分数的定义
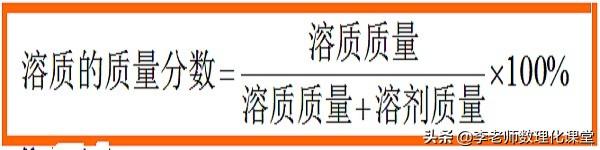
溶液中溶质的质量分数的定义:溶质的质量与溶液的质量之比;
公式一:

因为:溶液质量=溶质质量+溶剂质量
所以:公式二:
公式说明:

①溶质的质量分数为比值,没有单位;
②溶质的质量分数为百分比,写成百分之几的形式;
例题1:100g氯化钠溶液中含有氯化钠10g,求该氯化钠溶液中溶质的质量分数?

例题2:10g氯化钠固体溶于100g水中形成氯化钠溶液,求该氯化钠溶液中溶质的质量分数?

1.2、溶质的质量分数的意义
溶质的质量分数的意义:表示一定量的溶液中所含溶质质量多少,也表示溶液浓度的大小。
- 溶质的质量分数越大,说明溶液的浓度越大。
举例1:溶质质量分数越大的硫酸铜溶液,其溶液浓度越大,溶液颜色越深;
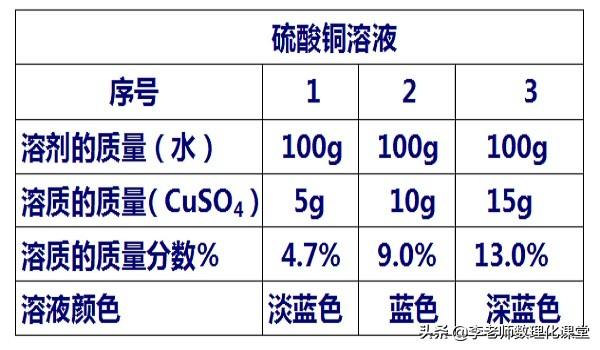
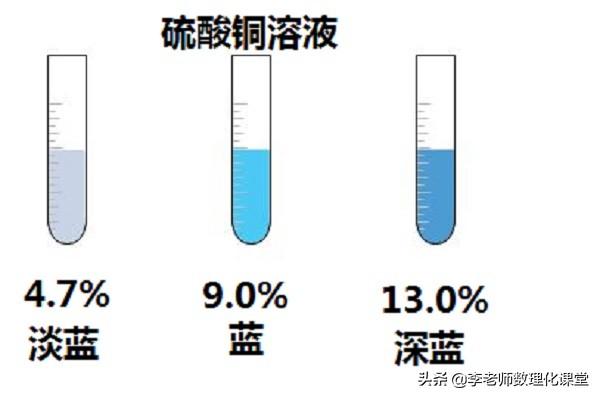
举例2:溶质的质量分数越大的蔗糖溶液,其溶液浓度越大,溶液越甜;
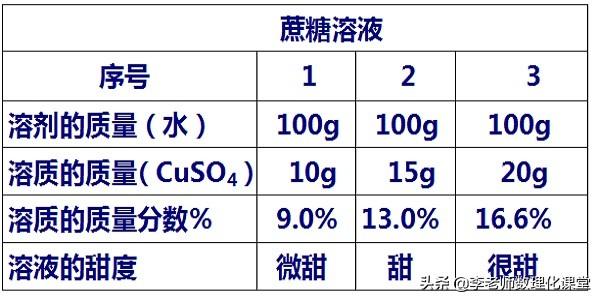
1、溶液中溶质的质量分数的习题总结
2.1、溶液稀释问题
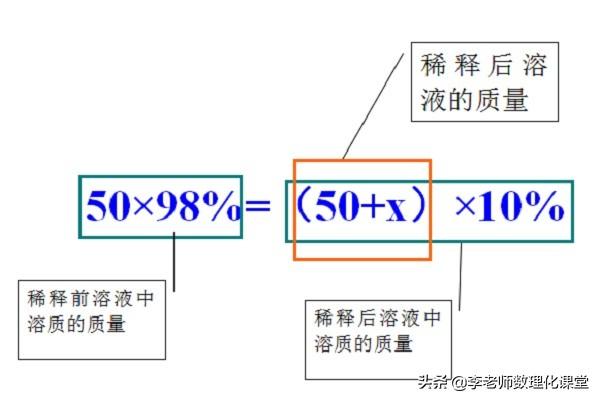
溶液稀释:向溶液中加入溶剂(水),让浓度较大的溶液变成浓度较小的溶液过程。整个过程中溶质的质量不变,溶剂的质量增加。

解题方法:稀释前溶质的质量=稀释后溶质的质量
例题:把50g溶质质量分数为98%的浓硫酸溶液,稀释成质量分数为10%的稀硫酸溶液,需要加水多少克?

2.2、溶液增浓问题
溶液增浓:通过向溶液中增加溶质的量或蒸发溶剂的量或加入其更浓的溶液,让溶液的浓度变大的过程。
溶液增浓的三种方法:
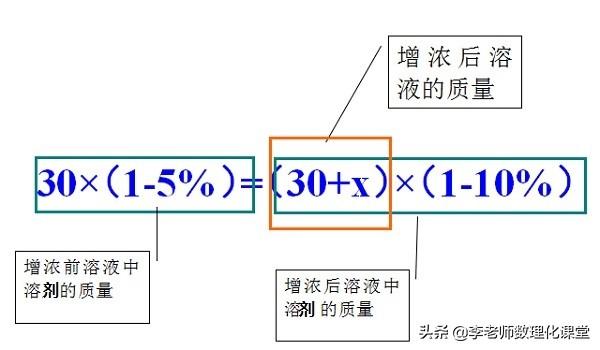
①方法一:加入溶质,加入前后:溶剂质量不变;
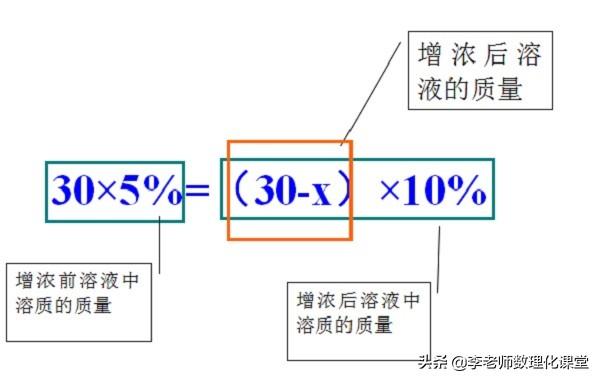
②方法二:蒸发溶剂,蒸发前后:溶质质量不变;
③方法三:加入其更浓的溶液,加入前后:溶质和溶剂的质量都增加;
1.2.1、加溶质的方法(前后溶剂质量不变)
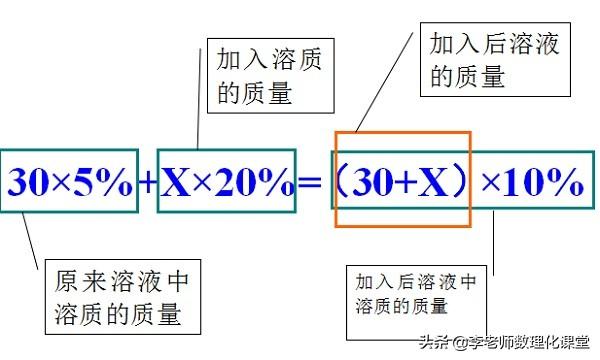
例题:有30g溶质质量分数为5%的硫酸铜溶液,若将其溶质质量分数增加到10%,需要向溶液中加入多少克硫酸铜固体?

1.2.2、蒸发溶剂方法(前后溶质质量不变)
例题:有30g溶质质量分数为5%的硫酸铜溶液,若将其溶质质量分数增加到10%,需要将溶液中的水蒸发多少克?

2.2.4、加入其更浓的溶液(前后:溶质和溶剂的质量都增加)
例题:有30g溶质质量分数为5%的硫酸铜溶液,若将其溶质质量分数增加到10%,需要向溶液中加溶质质量分数20%硫酸铜溶液多少克?

2.3、浓溶液和稀溶液混合问题
浓溶液和稀溶液混合:将同种溶液的浓溶液和稀溶液混合。混合后溶液的溶质质量等于混合前浓溶液中溶质质量与稀溶液中溶质质量之和。
- 浓溶液的溶质质量+稀溶的液溶质质量=混合后溶液的溶质质量
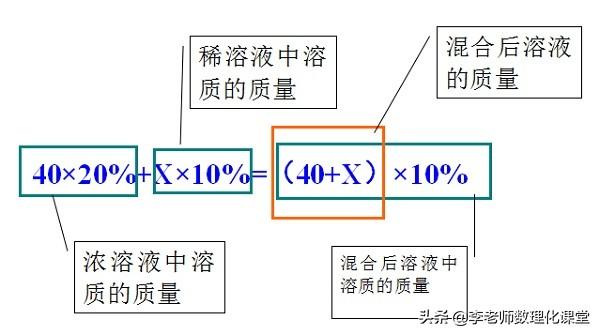
例题:40g溶质质量分数为20%的硫酸铜溶液与多少克溶质质量分数为10%的硫酸铜溶液混合后,可制得15%的硫酸铜溶液。

2.4、含结晶水物质溶于水,溶质质量分数计算问题
含结晶水物质溶于水后,结晶水会消失,溶质的质量需要去除结晶水,溶剂的质量需要加上结晶水。




2.5、溶液混合时,体积不可相加,质量可相加
①因为分子间存在间隙,两溶液混合后的总体积不等于各自溶液体积之和
- 如20ml溶质质量分数为10%的硫酸溶液与30ml 溶质质量分数为20%的硫酸溶液混合。
- 混合溶液总体积不等于20ml+30ml
②两溶液混合后的总质量等于各自溶液质量之和
- 如20g溶质质量分数为10%的硫酸溶液与30g 溶质质量分数为20%的硫酸溶液混合。
- 混合溶液总质量=20g+30g
例题:把100 ml98%的浓硫酸(密度为1.84g/ml)稀释成10%的稀硫酸(密度为1.07g/ml),需要加水多少ml?