弱电解质的电离、盐的水解、不溶性电解质的溶解等问题都涉及到化学平衡的概念。基于此,研究此类问题,要从平衡的角度出发,用化学平衡的概念来分析问题。化学平衡的研究对象是一定条件下的可逆反应,而弱电解质的电离、盐的水解、不溶性电解质的溶解等。都是可逆反应,它们在水溶液中的行为都表现为动态平衡。这些平衡可以看作是化学平衡(水溶液中的化学平衡)的特例,因而既有化学平衡的共性,又有其鲜明的特点。
1。弱电解质的电离(以C3cooh的电离为例)
(1)弱电解质的电离:C3cooh

CH3COO—+H+.
(2)电离平衡常数:用k表示,CH3COOH的电离平衡常数可表示为k(ch 3c ooh)=[C(h+)C(ch 3c ooh-)]/C(ch 3c ooh)。
注:电离平衡常数只随温度的变化而变化,不随参与电离平衡的分子和离子的浓度而变化。k电离表达式中的每个浓度指的是平衡时的浓度。25℃的电离常数通常用来讨论室温下各种弱电解质溶液的平衡状态。多弱酸是分步电离的,每一步电离都有相应的电离常数,通常用K1、K2、K3等表示。,其震级关系为K1 > K2 > K3,一般相差104 ~ 105倍。
(3)弱电解质电离的特征:
①共同特征:动态(动态平衡)、恒定(各粒子含量不变)等。(电离的速率等于离子结合成分子的速率),可变的(条件变化时平衡移动)。
②人格特征:电离时吸热;电离度小。
(4)外界条件对电离平衡的影响:
①浓度:随着弱电解质浓度的增加,电离平衡右移,溶质分子电离度降低;当离子浓度增加时,电离平衡向左移动,溶质分子的电离度降低。
②温度:温度升高,电离平衡右移,溶质分子电离度增大;当温度降低时,电离平衡向左移动,溶质分子的电离度降低。
注:区分电离平衡移动与电离度变化的关系。电离平衡移动的方向用化学平衡移动的原理分析,电离度是一个相对值。即使电离平衡右移,电离度也不一定增加。例如,随着弱电解质浓度的增加,电离平衡右移,但未电离的弱电解质分子数量增加更多,溶质分子的电离度反而降低。
]S2。盐的水解
(1)盐水解的本质:盐电离的弱离子(弱酸离子或弱碱阳离子)与水电离的H+或OH-结合生成弱电解质,打破了水的电离平衡,从而使溶液呈酸性或碱性。
(2)盐水解的规律:
根据盐离子对应的酸或碱的相对强度来判断盐是否水解以及水解溶液的酸碱性。水解法则:“有弱点就水解;如果没有弱点,就不会水解;如果是弱的,就会水解;如果是弱的,就会水解;强则中和。”
(3)盐水解的特性:
①共同特性:动态(动态平衡)、恒定(各颗粒含量不变)等。(离子水解的速率等于分子电离的速率),可变的(当条件改变时平衡移动)。
②个性:盐的水解过程是吸热的;盐的水解程度通常很小。
(4)盐水解反应方程式的书写:
①盐水解一般较弱,反应可逆,所以盐水解反应的离子方程式要用“

“,水解产生的不溶物和气体一般不标注“左”或“左”(双水解反应除外)。例如FeCl3水解:Fe3++3H2O

Fe(OH)3+3H+.
S2。不溶性电解质的溶解
(1)溶解平衡:对于不溶性电解质AmBn,存在平衡AmBn(s)

Fe(OH)3+3H+.
S2。不溶性电解质的溶解
(1)溶解平衡:对于不溶性电解质AmBn,存在平衡AmBn(s)

mAn+(aq)+nBm—(aq).
(2)溶度积常数:
在一定温度下,不溶性电解质饱和溶液中各组离解子的浓度幂的乘积为常数,称为溶度积常数,简称溶度积,用符号“Ksp”表示。不溶性电解质AmBn: AmBn(s)的溶解平衡

曼+(AQ)+NBM-(AQ),其溶度积常数为KSP = [c(An+)] m [C (BM-)] n,其中c(An+)和C (BM-)为平衡浓度。
注: KSP与物质浓度无关,与温度和化学方程式的写法有关,例如Cu(OH)2(s)

Cu2+(AQ)+2OH-(AQ)的溶度积为KSP = C (Cu2+) C2 (OH-),而1/2Cu(OH)2(s)


1/2cu2+(AQ)+OH-(AQ)的溶度积为KSP2 = C1/2 (Cu2+) C (OH-),显然KSP = (KSP2) 2。
(3)溶解平衡的特征:
①常见特征:动态(动态平衡)、恒定(各粒子含量不变)、相等(溶解速率等于电离速率)、可变(条件变化时平衡移动)。
②性格特点:溶解过程吸热;溶解程度小。
(4)溶度积法则:
在任何情况下离子在某种不溶性电解质溶液中的浓度的乘积Qc(离子乘积),则QC = [c(An+)] m [c (BM-)] n,其中c(An+)和c (BM-)为任意浓度。
①当QC > KSP时,溶液过饱和,溶液中有沉淀,直至溶液饱和,达到新的平衡;
②当QC = KSP时,溶液达到饱和,沉淀和溶解处于平衡状态;
③当QC < KSP时,溶液不饱和,溶液中没有沉淀。如果加入过量的不溶性电解质,不溶性电解质会溶解直至溶液饱和,达到新的平衡。
(5)外界条件对溶出平衡的影响:
溶出平衡主要受温度影响。一般来说,随着温度的升高,不溶性电解质的溶解平衡右移,溶解程度和电离度增加。
二。化学守恒
守恒是化学反应过程中应遵循的基本原理。水溶液中的化学反应,有很多守恒关系,比如电荷守恒,物质守恒,质子守恒。
1电荷守恒关系:
电荷守恒是指无论电解质溶液中存在多少种离子,电解质溶液都必须是电中性的,即溶液中阳离子携带的正电荷总数等于阴离子携带的负电荷总数,方程可以用离子浓度代替电荷浓度来表示。常用于比较溶液中离子的浓度或计算一种离子的浓度,例如:
①在NaHCO3溶液中:C(Na+)+C(H+)= C(OH-)+2C(Co32-)+C(HCO 3-);
②在(NH4)2SO4溶液中:C (NH4+)+C (H+) = C (OH-)+C (SO4 2-)。
]S2。材料守恒:
材料守恒就是元素守恒。电解质溶液中的离子会因电离或水解因素而变成其他离子或分子,但离子或分子中某一特定元素的总原子数不会改变。从电解质的化学式来看,各元素的原子之间存在守恒关系,要同时考虑盐本身的电离、盐的水解和离子比。例如:
①在NaHCO3溶液中:C(Na+)= C(Co32-)+C(HCO 3-)+C(h2co 3);
②在NH4Cl溶液中:C(Cl-)= C(NH4+)+C(NH3·H2O)。
S2。质子守恒关系:
酸碱反应达到平衡时,酸(包括广义酸)失去的质子总数(H+)等于碱(或广义碱)得到的质子总数(H+),失去和得到的质子数(H+)相等的这种关系就是这样的。
在盐溶液中,溶剂水也会电离:H2O。

H++OH-,从水分子的角度分析:被H2O电离的H+总数等于被H2O电离的OH-总数(包括已被其他离子结合的部分),从电荷和物质守恒可以推导出来,例如:
①在NaHCO3溶液中:C (OH-) = C (H+)+C (Co32-)+
②在NH4Cl溶液中:C(h+)= C(OH-)+C(NH3·H2O)。
综上所述,化学守恒概念不仅是分析溶液中粒子间关系的重要概念,也是解决溶液中粒子间浓度关系问题的重要基础。
三。离子反应
离子反应是从溶液中离子相互作用的角度来理解化学反应的本质,阐明化学反应的机理。
1.离子反应的本质
离子反应的本质是指反应物的某些离子浓度降低。本质上,如果反应物的某些离子能够反应生成新的物质,并降低这些离子在溶液中的浓度,就会发生离子反应。
2。离子反应发生的条件
研究离子反应发生的条件,实质上就是研究反应物的某些离子浓度可以降低的条件。一般来说,下列条件之一可以降低反应物某些离子浓度。
①不溶物的形成:
不溶物的形成可以降低某些离子的浓度,所以可以发生离子反应。例如将硝酸酸化的AgNO3溶液滴入NaCl溶液中,会发生如下反应:A g++Cl-= = AgCl ↓(可溶→不溶,降低Cl-浓度)。
②难电离物质的生成:
难电离物质的生成(如弱酸、弱碱或生成水等。)可以降低某些离子的浓度,所以可以发生离子反应。比如盐酸和苛性钠的中和反应:H++OH-= H2O生成难以电离的水。
③生成挥发性物质:
如果离子能够结合生成气体,可以降低部分离子的浓度,发生离子反应。一般来说,判断是基于不稳定酸(H2CO3、H2SO3等)的生成。)、不稳定碱(如NH3·H2O)和挥发性酸(如H2S)。
④发生氧化还原反应:一般来说,在适宜的酸碱溶液中,强氧化性物质和强还原性物质之间可以发生氧化还原反应,如NO3—、H+和Fe2+。
3。离子方程式的意义
离子方程式不仅代表某些物质的某一特定反应,还代表所有同类型物质之间的某一类反应,更能反映这类反应的本质,更具典型性和一般性。比如离子方程式H++OH-= = H2O不仅代表了盐酸和烧碱溶液的中和反应,也代表了所有强酸强碱都被中和生成可溶性盐和水的一种反应。
4。离子方程式的书写步骤
书写离子方程式一般可分为四个步骤:
(1)书写——根据客观事实写出正确的化学方程式。
(2)反汇编——把水溶性和易电离的物质写成离子形式,用分子式表示不溶于水或难电离的物质、气体、单质和氧化物。对于不溶于水但溶于酸的物质,如CaCO3、FeS、Cu(OH)2、Mg(OH)2等。,分子式还是写的。
(3)删除——对于另一个程序两边相同的离子,不参与反应的离子要“按数”删除。
(4)检查——检查写出的离子方程式是否满足前三项要求,是否满足质量和电荷守恒。
高考题中离子反应概念的考查形式主要有离子方程式的书写与判断、离子共存、离子推论以及离子反应在生产生活中的应用。
四。化学实验[/s2/]
化学实验的内容非常丰富,包括实验原理的理解、实验操作、注意事项、数据处理和误差分析等。,并转化为我们自己的化学学科素质,在解决实验问题的过程中,实现解题的自动化、有序化、精确化。电解质题目中,化学实验概念的考查主要围绕“酸碱中和滴定”的定量实验,考查中和滴定实验操作的相关知识及其迁移应用。
1。实验原理:
用已知物质的酸(或碱)通过中和反应来测定未知物质的碱(或酸)的一种实验方法。
2。指示剂的选择:
在中和滴定过程中,指示剂往往是预先滴入被滴定溶液中,置于锥形瓶中。在选择指示剂时,可以考虑中和时生成的盐的水解情况,先判断滴定结束时溶液的酸碱度,再决定选择哪种指示剂。
甲基橙和酚酞由于变色范围窄,变色相对灵敏,通常用作中和滴定的指示剂,而石蕊由于变色范围宽,不灵敏,一般不作为中和滴定的指示剂。
3。操作流程:检漏→仪器清洗→加湿清洗→充液→测量→滴定→计算。
(1)滴定操作:左手控制滴定管的活塞或玻璃球,右手不断摇动锥形瓶,并随时注意锥形瓶内溶液的颜色变化。
(2)滴速控制:先快后慢,接近终点时要一滴一滴的摇。
(3)判断终点:当滴完最后一滴时,溶液的盐酸发生变化,在30s内不恢复原来的颜色,即为滴定终点。
4。误差分析:
中和滴定误差分析依据:C(待定)= 1
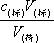
从上式可以看出,如果用标准溶液滴定待测液体,消耗的标准溶液较多,结果偏高;反之,则低。待测溶液浓度的准确度仅取决于滴定管中的体积读数。这种体积误差往往是由:①读数、②仪器冲洗、③滴定管泄漏、④标准溶液不标准(如称量、配制、混入杂质等)造成的。)、⑤指示器使用不当、⑥待测液体的测量等。
性,然后确定选择以上哪个指标。
甲基橙和酚酞由于变色范围窄,变色相对灵敏,通常用作中和滴定的指示剂,而石蕊由于变色范围宽,不灵敏,一般不作为中和滴定的指示剂。
3。操作流程:检漏→仪器清洗→加湿清洗→充液→测量→滴定→计算。
(1)滴定操作:左手控制滴定管的活塞或玻璃球,右手不断摇动锥形瓶,并随时注意锥形瓶内溶液的颜色变化。
(2)滴速控制:先快后慢,接近终点时要一滴一滴的摇。
(3)判断终点:当滴完最后一滴时,溶液的盐酸发生变化,在30s内不恢复原来的颜色,即为滴定终点。
4。误差分析:
中和滴定误差分析依据:C(待定)= 1
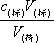
从上式可以看出,如果用标准溶液滴定待测液体,消耗的标准溶液较多,结果偏高;反之,则低。待测溶液浓度的准确度仅取决于滴定管中的体积读数。这种体积误差往往是由:①读数、②仪器冲洗、③滴定管泄漏、④标准溶液不标准(如称量、配制、混入杂质等)造成的。)、⑤指示器使用不当、⑥待测液体的测量等。